FeO + HNO3 Viết Cân bằng phương trình phản ứng hóa học, phản ứng oxi hóa khử khi cho sắt oxit tác tác dụng với dung dịch HNO3 loãng sau phản ứng thu được muối sắt (III) và khí không màu hóa nâu trong không khí. Trong suốt chương trình môn hóa học Ở các dạng đề thi học kỳ và THPT quốc gia, luôn có các dạng bài tập khác nhau trong đó có cả viết phương trình phản ứng hóa học đã cân bằng. Hi vọng tài liệu của svnckh cung cấp cho các bạn được kiến thức quan trọng nhất để giải bài tập một cách hiệu quả. Mời các bạn cùng theo dõi.
Xem thêm tại đây :

Viết phương trình phản ứng hóa học :
FeO + HNO3 → Fe(NO3)3 + NO + H2O
Trong đó :
FeO là Sắt(II) oxide chất rắn màu đen
HNO3 là dung dịch axit nitric không màu
Fe(NO3)3 là Sắt Nitrat chất rắn màu trắng
NO là khí Nitric oxit màu nâu
H2O là nước chất lỏng không màu
Cân bằng phương trình FeO + HNO3 → Fe(NO3)3 + NO + H2O
Fe+2O + HN+5O3 → Fe+3(NO3)3 + N+2O + H2O
Ta có :
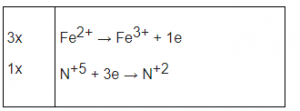
Phương trình phản ứng đã cân bằng :
3FeO + 10HNO3 ⟶ 5H2O + NO + 3Fe(NO3)3
Điều kiện để phương trình diễn ra : Nhiệt độ
Thực hiện thí nghiệm :
Cho oxit sắt II tác dụng với dung dịch axit HNO3 ta thấy xuất hiện Chất rắn màu đen Sắt II Oxit (FeO) tan dần và xuất hiện khí Nito oxit (NO) hóa nâu ngoài không khí.
Các phương trình điều chế FeO :
– CaO + FeS ⟶ FeO + CaS
– Fe + Fe3O4 ⟶ 4FeO
– Fe(OH)2 ⟶ FeO + H2O
– Fe + Fe2O3 ⟶ 3FeO
FeO là chất gì?
– Sắt (II) oxit (FeO) là oxit bazo. Sắt (II) oxit là hợp chất tạo bởi một nguyên tố Fe và một nguyên tử oxi.
– Công thức phân tử: FeO.
– Công thức cấu tạo: Fe=O
Tính chất lí hóa của FeO :
Tính chất vật lí
– FeO là chất rắn màu đen, không có trong tự nhiên.
– Không tan trong nước.
Tính chất hoá học
+ Là oxit bazơ:
FeO + 2HCl → FeCl2 + H2
FeO + H2SO4 loãng → FeSO4 + H2O
+ FeO là chất oxi hóa khi tác dụng với các chất khử mạnh: H2, CO, Al → Fe:
FeO + H2 → Fe + H2O (to)
FeO + CO → Fe + CO2 (to)
3FeO + 2Al → Al2O3 + 3Fe (to)
+ FeO là chất khử khi tác dụng với các chất có tính oxi hóa mạnh:
4FeO + O2 → 2Fe2O3
3FeO + 10HNO3 loãng → 3Fe(NO3)3 + NO + 5H2O