Trong hóa học khi các nguyên tử kết hợp với nhau sẽ tạo thành một hay nhiều hợp chất khác nhau và thường được gọi là liên kết ion hoặc cộng hóa trị. Trong một liên kết ion, một nguyên tử nhường một electron cho nguyên tử kia để ổn định nó. Trong liên kết cộng hóa trị, các nguyên tử được chia sẻ bởi các electron.
Liên kết ion là gì ?
khái niệm :
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
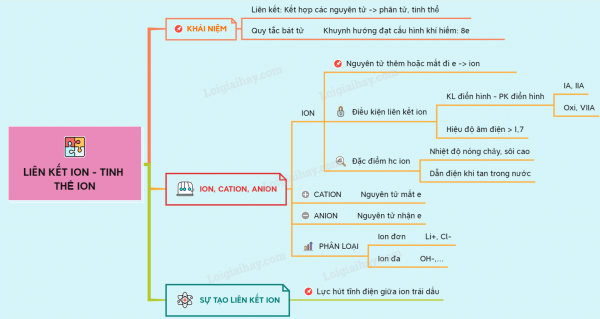
Quy tắc bát tử
– Trong các nguyên tử khí hiếm, nguyên tử heli chỉ có 2 electron nên có 2 electron ở lớp thứ nhất cũng là lớp ngoài cùng, còn các nguyên tử khí hiếm khác để có 8 electron ở lớp ngoài cùng.
⇒ Như vậy, cấu hình với 8 electron ở lớp ngoài cùng (hoặc 2 electron đối với heli) là cấu hình electron vững bền.
– Theo quy tắc bát tử (8 electron) thì nguyên tử của các nguyên tố có khuynh hướng liên kết với các nguyên tử khác để đạt được cấu hình electron vững bền của các khí hiếm với 8 electron (hoặc 2 đối với heli) ở lớp ngoài cùng.
SỰ TẠO THÀNH LIÊN KẾT ION, ANION, CATION
1. Sự tạo thành ion.
– Trong phản ứng hóa học, khi nguyên tử, phân tử thêm hoặc mất bớt electron nó sẽ tạo thành các phần tử mang điện được gọi là ion. Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo thành hợp chất chứa liên kết ion.
– Điều kiện hình thành liên kết ion:
+ Liên kết được hình thành giữa các nguyên tố có tính chất khác hẳn nhau (kim loại điển hình và phi kim điển hình).
+ Quy ước hiệu độ âm điện giữa hai nguyên tử liên kết ≥ 1,7 là liên kết ion (trừ một số trường hợp).
– Dấu hiệu cho thấy phân tử có liên kết ion:
+ Phân tử hợp chất được hình thành từ kim loại điển hình (kim loại nhóm IA, IIA) và phi kim điển hình (phi kim nhóm VIIA và Oxi).
Ví dụ: Các phân tử NaCl, MgCl2, BaF2,…đều chứa liên kết ion, là liên kết được hình thành giữa các cation kim loại và anion phi kim.
+ Phân tử hợp chất muối chứa cation hoặc anion đa nguyên tử.
Ví dụ: Các phân tử NH4Cl, MgSO4, AgNO3,… đều chứa liên kết ion, là liên kết được hình thành giữa cation kim loại hoặc amoni và anion gốc axit.
– Đặc điểm của hợp chất ion: Các hợp chấy ion có nhiệt độ nóng chảy và nhiệt độ sôi cao, dẫn điện khi tan tròn nước hoặc nóng chảy.
– Ion được chia thành cation và anion:
Cation : Ion dương
Anion : Ion âm
2. Sự tạo thành cation
– Ion mang điện tích dương gọi là ion dương hay cation.
– Nếu các nguyên tử nhường bớt electron khi tham gia phản ứng hóa học nó sẽ trở thành các phần tử mang điện tích dương hay còn gọi là cation.
Ví dụ: Sự hình thành Cation của nguyên tử Li(Z=3)
Cấu hình e: 1s22s1
1s22s1 → 1s2 + 1e
(Li) (Li+)
Hay: Li → Li+ + 1e
Li+ gọi là cation liti
3. Sự tạo thành anion
– Ion mang điện tích âm gọi là ion âm hay anion.
– Nếu các nguyên tử nhận thêm electron khi tham gia phản ứng hóa học nó sẽ trở thành các phần tử mang điện tích âm hay còn gọi là anion.
Ví dụ: Sự hình thành anion của nguyên tử F(Z=9)
Cấu hình e: 1s22s22p5
1s22s22p5 + 1e → 1s22s22p6
(F) (F-)
Hay: F + 1e → F-
F-gọi là anion florua
4. Ion đơn nguyên tử và ion âm đa nguyên tử
– Ion đơn nguyên tử là ion tạo nên từ 1 nguyên tử .
Thí dụ: cation Li+, Na+, Mg2+và anion F-, Cl-…….
– Ion đa nguyên tử là những nhóm nguyên tử mang điện tích dương hay âm .
Thí dụ: cation amoni NH4+, anion hidroxit OH-, anion sunfat SO42-, …….
xem thêm :
sơ đồ tư duy nhóm Halogen trong bảng tuần hoàn hóa học
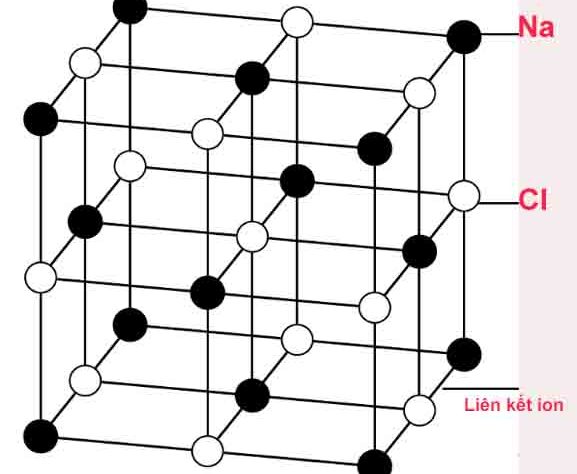
Sự hình thành liên kết ION
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Liên kết ion dược hình thành giữa kim loại điển hình và phi kim điển hình.
Thí dụ:
Xét sự hình thành liên kết ion trong phân tử NaCl
Nguyên tử Na (1s22s22p63s1) nhường 1 electron cho nguyên tử Cl (1s22s22p6), đồng thời nguyên tử clo nhận 1 electron của nguyên tử Na để biến đổi thành anion Cl- (1s22s22p63s23p6), có thể biểu diễn quá trình trên như sau:
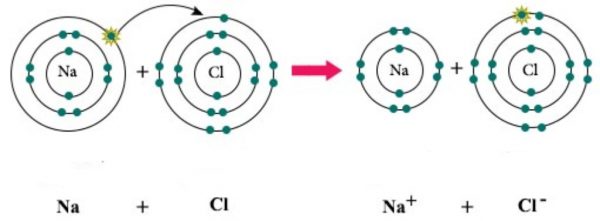
Na + Cl → Na+ + Cl-
Hai ion được tạo thành mang điện tích ngược dấu hút nhau bằng lực hút tĩnh điện, tạo nên phân tử NaCl:
Na+ + Cl- → NaCl
Liên kết giữa cation Na+ và anion Cl- là liên kết ion.
Phản ứng hoá học trên có thể được biểu diễn bằng phương trình hoá học sau:
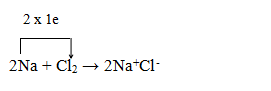
xem thêm :
Axit clohidric là gì ? tính chất và cách điều chế axit clohidric
Hidro clorua là gì? cấu tạo phân tử và tính chất của Hcl