Ở bộ môn hóa học, tất cả mọi người đều biết các dòng hóa chất nổi bật trong đó có hóa chất axit nitric có công thức là HNO3. Nó là một hợp chất hoá học được dùng nhiều trong đời sống hiện tại, có tính axit và oxi hóa mạnh. Vậy để điều chế được axit nitric thì những hóa chất nào có thể điều chế HNO3, Mời các bạn cùng theo dõi xem bài viết dưới đây về Cách điều chế HNO3 trong phòng thí nghiệm, Bao gồm những hóa chất nào ? của chúng tôi nhé.
Câu hỏi vận dụng :
Để điều chế HNO3 trong phòng thí nghiệm người ta dùng :
A. KNO3 và H2SO4 đặc
B. NaNO3 và HCl
C. NO2 và H2O
D. NaNO2 và H2SO4 đặc
Đáp án hướng dẫn giải
Để điều chế HNO3 trong phòng thí nghiệm người ta dùng KNO3 và H2SO4đặc
H2SO4 + KNO3 → KHSO4+ HNO3
Axit nitric là gì? (HNO3)
Axit nitric có công thức hóa học HNO3, được gọi là dung dịch nitrat hidro hay còn được gọi là axit nitric khan. Axit này được hình thành từ trong tự nhiên, tạo ra từ các cơn mưa do sấm và sét tạo thành.
Tính chất lý hóa của HNO3:
Tính chất vật lý :
+ Axit nitric tinh khiết là chất lỏng, không màu, bốc khói mạnh trong không khí ẩm, D=1,53 g/cm3
+ Axit nitric kém bền. Ngay ở điều kiện thường, khi có ảnh sáng, dung dịch axit nitric bị phân hủy một phần giải phóng nitơ đioxit. Khí này tan trong dung dịch axit làm dung dịch có màu vàng.
+ Axit nitric tan trong nước ở bất kì tỉ lệ nào. Trong phòng thí nghiệm thường có loại HNO3 nồng độ 68%, D=1,40 g/cm3.
Tính chất hóa học của axit nitric ( HNO3 ) :
Xem thêm tại đây :
Nitric acid là một axit mạnh, phải nói là một trong những axit mạnh nhất, do đó, nó mang đặc trưng của một axit và một vài đặc điểm của những axit mạnh nhất như:
* Làm quỳ tím chuyển thành màu đỏ.
– HNO3 tác dụng kim loại đứng trước H tạo thành muối và khí hidro.
Fe + 2HNO3 → Fe(NO3)2 + H2↑
6HNO3 + 2Al → 2Al(NO3)3 + 3H2↑
2HNO3 + Mg → Mg(NO3)2 + H2↑
– HNO3 tác dụng với oxit kim loại
HNO3 tác dụng oxit kim loại tạo thành muối và nước.
6HNO3 + Al2O3 →2Al(NO3)3 + 3H2O
Fe3O4 + 8HNO3 → 4H2O + Fe(NO3)2+ 2Fe(NO3)3
2HNO3 + CuO → Cu(NO3)2 + H2O
– HNO3 tác dụng với bazơ.
HNO3 tác dụng bazơ dung dịch hoặc bazơ rắn tạo thành muối và nước
3HNO3 + Al(OH)3 → Al(NO3)3 + 3H2O
2HNO3 + 2NaOH → 2NaNO3 + H2O
2HNO3 + Ca(OH)2 → Ca(NO3)2 + 2H2O
2HNO3 + Fe(OH)2 → Fe(NO3)2 + 2H2O
– HNO3 tác dụng với muối
HNO3 tác dụng muối tạo thành muối và axit mới
*Điều kiện: tạo kết tủa, khí bay lên hoặc axit mới yếu hơn
K2CO3 + 2HNO3 → 2KNO3 + H2O + CO2↑
2HNO3 + BaS → Ba(NO3)2 + H2S↑
CaCO3 + 2HNO3 → Ca(NO3)2 + H2O + CO2↑
– Bình thường, HNO3 không giải phóng Hidro (H2) khi có phản ứng với kim loại và tạo thành các muối có trạng thái oxy hóa ở mức cao hơn. Vì vậy, khi bảo quản Axit nitric thì không nên chứa trong những dụng cụ bằng kim loại, phổ biến là người ta sẽ chứa Acid nitric trong các can nhựa tối màu, thường thấy nhất là màu đen.
Điều chế HNO3
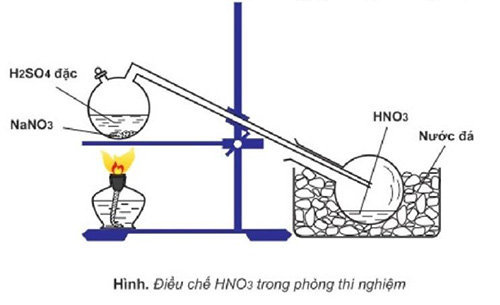
– Trong phòng thí nghiệm
Để điều chế HNO3 trong phòng thí nghiệm, người ta cho muối natri nitrat tinh thể tác dụng với axit sunfuric đặc, chưng cất hỗn hợp này tại nhiệt độ sôi của axit nitric là 83 °C cho đến khi còn lại chất kết tinh màu trắng theo phương trình như sau:
H2SO4 đặc + NaNO3 (tinh thể) → HNO3 + NaHSO4
Axit nitric bốc khói đỏ thu được có thể chuyển thành axit nitric màu trắng. Khi thực hiện thí nghiệm , các dụng cụ phải làm từ thủy tinh, đặc biệt là bình cổ cong nguyên khối do axit nitric khan.
Ngoài ra còn một cách khác nữa đó là:
Axit nitric có thể được tạo ra bằng cách phân hủy nhiệt của đồng (II) nitrat , tạo ra khí nitơ dioxide và khí oxy, sau đó được truyền qua nước để tạo ra axit nitric.
2Cu(NO3)2 → 2 CuO + 4 NO2 + O2
4 NO2 + O2 →HNO2 +HNO3
– Trong công nghiệp
Dung dịch HNO3 cấp thương mại thường có nồng độ giữa 52% và 68%. Việc sản xuất nó được thực hiện bằng công nghệ Ostwald do Wilhelm Ostwald phát minh.
Axit nitrit loãng có thể cô đặc đến 68% axit với một hỗn hợp azeotropic với 32% nước. Để thu được axit có nồng độ cao hơn, tiến hành chưng cất với axit sunfuric H2SO4. H2SO4 đóng vai trò là chất khử sẽ hấp thụ lại nước.
4NH3 + 5O2 → 4NO + 6H2O (Pt, 850oC)
2NO + O2 → NO2
4NO2 + O2 + 2H2O → 4HNO3
Như vậy trong bài viết này chúng tôi đã hướng dẫn các bạn cách điều chế HNO3, Hi vọng sẽ giúp các bạn cách chọn hóa chất chuẩn để điều chế ra HNO3. Mời các bạn xem thêm phương trình phản ứng HNO3 khác của chúng tôi, Xin cảm ơn.