P2O5 + H3PO4 Đây là phương trình phản ứng hóa học khi diphotpho penta oxit tác dụng với axit photphoric ở điều kiện gì? chất xúc tác kèm theo và cách thực hiện phương trình thí nghiệm là gì? Mời các bạn cùng theo dõi bài viết dưới đây để củng cố thêm kiến thức trong quá trình làm bài tập cũng như làm thí nghiệm liên quan đến diphotpho penta oxit và axit photphoric.
Chú ý :
Cân bằng phương trình phản ứng hóa học đã cho :
| P2O5 | + | 4H3PO4 | → | 3H4P2O7 |
| diphotpho penta oxit | axit photphoric | axit điphotphoric | ||
| axit |
Điều kiện phản ứng : Không có
Cách thực hiện phương trình : ta cho diphotpho penta oxit tác dụng với axit photphoric ta thấy xuất hiện Chất rắn màu trắng Diphotpho pentaoxit (P2O5) tan dần.
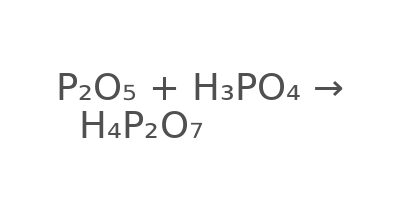
P2O5 là gì?
P2O5 là công thức phân tử của ĐIPHOTPHO PENTA OXIT, Gồm 2 nguyên tử P link với 5 nguyên tử O bằng những link cộng hóa trị .
P2O5 Là chất khói trắng, không mùi, háo nước và dễ chảy rữa thường dùng để làm khô những chất .
Công thức phân tử: P2O5
Phân tử khối: 142 g/mol
Bài tập áp dụng :
Bài 1 : Cho 100 ml dung dịch H3PO4 0,2 M vào 1 lit dung dịch Ca(OH)2 0,012 M. Tính khối lượng muối tạo thành sau khi phản ứng xảy ra hoàn toàn.
Lời giải
nH3PO4 = 0,02 mol ; nOH – = 0,024 mol
T = 0,024 / 0,02 = 1,2 ⇒ tạo ra 2 muối H2PO4 – và HPO42 –
Phương trình phản ứng :
Ca ( OH ) 2 + 2H3 PO4 → Ca ( H2PO4 ) 2 + 2H2 O
Ca(OH)2 + H3PO4 → CaHPO4 + 2H2O
Gọi số mol của Ca ( H2PO4 ) 2 và CaHPO4 lần lượt là x, y mol
Ta có : 2 x + y = 0,02 ( 1 ) và x + y = 0,012 ( 2 )
⇒ x = 0,008 mol và y = 0,004 mol
Khối lượng những muối sau phản ứng là :
mCa ( H2PO4 ) 2 = 0,008. 234 = 1,872 gam
mCaHPO4 = 0,004. 136 = 0,544 gam
Bài 2 : Cho 100 ml dung dịch H3PO4 tác dụng với 200 ml dung dịch NaOH a M thu được 1,2 gam muối NaH2PO4 và 1,42 mol Na2HPO4. Giá trị của a là:
Lời giải
nNa2HPO4 = 0,01 mol ; nNaH2PO4 = 0,01 mol ; nNaOH = 0,01 + 0,01. 2 = 0,03 mol ⇒ a = 0,03 / 0,2 = 0,15 M
Bài 3 : Tên gọi của P2O5
A. Điphotpho trioxit
B. Photpho oxit
C. Điphotpho oxit
D. Điphotpho pentaoxit
Lời giải
Chọn đáp án D