P2O5 + KOH → K3PO4 + H2O Giải phương trình phản ứng đã cho khi P2O5 tác dụng KOH và cân bằng chính xác phương trình. Các cách viết và giải phương trình phản ứng là vô cùng phức tạp và khó, Hãy tìm hiểu ở bài viết dưới đây để có đầy đủ điều kiện và cách thức thực hiện chuẩn xác nhất. Cùng theo dõi bài viết của chúng tôi nhé.
Cân bằng phương trình phản ứng hóa học :
P2O5+ 6KOH → 2K3PO4 + 3H2O
Các phương trình điều chế KOH :
– 2Ba(OH)2 + KAl(SO4)2 ⟶ Al(OH)3 + KOH + 2BaSO4
– 2H2O + KMnO4 + 3FeSO4 ⟶ Fe2(SO4)3 + KOH + MnO2 + Fe(OH)3
– Ba(OH)2 + K2CrO4 ⟶ 2KOH + BaCrO4
– K2CO3 + Ba(OH)2 ⟶ 2KOH + BaCO3
Điều kiện của phương trình: Nhiệt độ thường
Cách thực hiện : Cho KOH tác dụng với P2O5

Dạng bài tập P2O5 tác dụng với KOH hoặc dung dịch NaOH
Thực chất là axít H3PO4 (do P2O5 + H2O trong dung dịch KOH) tác dụng với KOH có thể xảy ra các phản ứng sau
H3PO4 + KOH → KH2PO4 + H2O (1)
H3PO4 + 2KOH → K2HPO4 + 2H2O (2)
H3PO4+ 3KOH → K3PO4 + 3H2O (3)
Giả sử có dung dịch chứa a mol H3PO4 tác dụng với dung dịch có chứa b mol KOH thu được dung dịch A ta có thể biện luận các chất theo tương quan giữa a và b như sau :
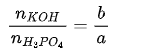
(1) Nếu 0 < b/a <1 chỉ xảy ra phản ứng (1) taọ ra KH2PO4và H3PO4 còn dư
(2) Nếu b/a = 1 phản ứng (1) vừa đủ tạo ra KH2PO4
(3) Nếu Nếu 1 < b/a <2 xảy ra cả phản ứng(1) và phản ứng (2) taọ ra KH2PO4 và K2HPO4
(4) Nếu b/a = 2 phản ứng (2) vừa đủ tạo ra K2HPO4
(5) Nếu Nếu 2 < b/a <3 xảy ra cả phản ứng (2) và phản ứng (3) taọ ra K3PO4 và K2HPO4
(6) Nếu b/a = 3 phản ứng (3) vừa đủ tạo ra K3PO4
(7) Nếu b/a > 3 chỉ xảy ra phản ứng (3) tạo ra K3PO4 và KOH còn dư
Nội dung tìm hiểu :
Câu hỏi chi tiết :
Câu 1. Cho 21,3 gam P2O5 tác dụng với 200g dung dịch KOH 8,4%. Muối nào được tạo thành? Khối lượng là bao nhiêu?
Cách giải chi tiết :
Các phản ứng xảy ra:
P2O5 + 3H2O → 2H3PO5(1)
H3PO4 + KOH → KH2PO4+ H2O (2)
H3PO4 + 2KOH → K2HPO4+ 2H2O (3)
H3PO4 + 3KOH → K3PO4 + 3H2O (4)
Theo phương trình (1) nH3PO4= 2nP2O5 = 2.21,3 : 142 = 0,3 mol
nKOH = (200.8,4) : (100.56) = 0,3 mol
Ta có tỉ lệ nKOH: nH3PO4 = 0,3 : 0,3 = 1 vậy chỉ xảy ra phản ứng (2) vừa đủ
H3PO4 + KOH → KH2PO4 + H2O
Muối tạo thành là KH2PO4 có số mol = nKOH = nH3PO4 = 0,3 mol
mKH2PO4 = 0,3 . 136 = 40,8 (g)
Câu 2. Cho P2O5 tác dụng với dung dịch KOH, người ta thu được dung dịch gồm 2 chất. Hai chất đó có thể là chất nào?
Cách giải chi tiết :
Hai chất đó không thể là Na3PO4 và H3PO4 vì 2K3PO4 + H3PO4 → 3K2HPO4
Hai chất đó không thể là KH2PO4 và KOH vì KH2PO4 + KOH → K3PO4+ H2O
Hai chất đó không thể là KH2PO4 và K3PO4 vì KH2PO4 + K3PO4 → 2K2HPO4
Vậy hai chất đó có thể là: K2HPO4 và K3PO4
