Quy tắc đường chéo là gì? Phương pháp sơ đồ đường chéo – Hóa 8, Hóa 11. Với nội dung bài viết dưới đây svnckh sẽ gửi đến các bạn cũng như các em học sinh nắm được kiến thức về phương pháp, quy tắc, sơ đồ đường chéo từ đó giúp các em thu thập được kiến thức quan trọng để giải quyết các bài tập từ cơ bản đến nâng cao một cách nhanh chóng nhất.
Phương pháp đường chéo là gì ?
Phương pháp đường chéo là phương pháp thường được áp dụng cho các bài toán hỗn hợp chứa 2 thành phần mà yêu cầu của bài toán là xác định tỉ lệ giữa 2 thành phần đó.
Đây là phương pháp có nhiều ưu điểm, giúp tăng tốc độ tính toán, và là 1 công cụ bổ trợ rất đắc lực cho phương pháp trung bình.
- Phương pháp đường chéo có thể áp dụng tốt cho nhiều trường hợp, nhiều dạng bài tập, đặc biệt là dạng bài pha chế dung dịch và tính thành phần hỗn hợp.
- Thường sử dụng kết hợp giữa đường chéo với phương pháp trung bình và phương pháp bảo toàn nguyên tố. Với hỗn hợp phức tạp có thể sử dụng kết hợp nhiều đường chéo.
- Trong đa số trường hợp không cần thiết phải viết sơ đồ dường chéo nhằm rút ngắn thời gian làm bài.
Nhược điểm của phương pháp này là không áp dụng được cho những bài toán trong đó có xảy ra phản ứng giữa các chất tan với nhau, không áp dụng được với trường hợp tính toán pH.
Tìm hiểu thêm : Nhiệt độ sôi của benzen là gì?
Phương pháp sơ đồ đường chéo là gì ?
– Nguyên tắc: Trộn lẫn hai dung dịch:
+) Dung dịch 1: có khối lượng m1, thể tích V1, nồng độ C1 (nồng độ phần trăm hoặc nồng độ mol), khối lượng riêng d1.
+) Dung dịch 2: có khối lượng m2, thể tích V2, nồng độ C2 (C2 > C1 ), khối lượng riêng d2.
+) Dung dịch thu được: có khối lượng m = m1 + m2, thể tích V = V1 + V2, nồng độ C (C1 < C < C2) và khối lượng riêng d.
– Sơ đồ đường chéo và công thức tương ứng với mỗi trường hợp là:
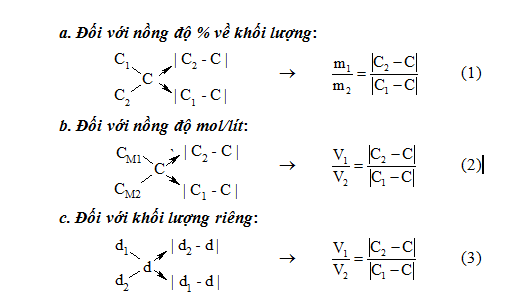
Chú ý :
+) Dung môi coi như dung dịch có C = 0%
+) Chất rắn coi như dung dịch có C = 100%
+) Khối lượng riêng của H2O là d = 1g/ml.
Phạm vi sử dụng của Phương pháp sơ đồ đường chéo :
+ Bài toán về đồng vị: Ta áp dụng sơ đồ đường chéo cho đại lượng khối lượng phân tử và số khối
+ Bài toán hỗn hợp khí: Ta áp dụng sơ đồ đường chéo cho tỉ lệ mol tương ứng với tỉ lệ chênh lệch phân tử khối các chất so với giá trị trung bình
+ Bài toán pha chế: Ta áp dụng sơ đồ đường chéo cho các đại lượng C%, CM, d,…
+ Bài toán xác định công thức, tính tỉ lệ các chất: Ta áp dụng cho các đại lượng, phân tử khối trung bình, số nguyên tử trung bình,….
Tìm hiểu thêm : Nhiệt độ sôi của các chất
Bài tập minh họa
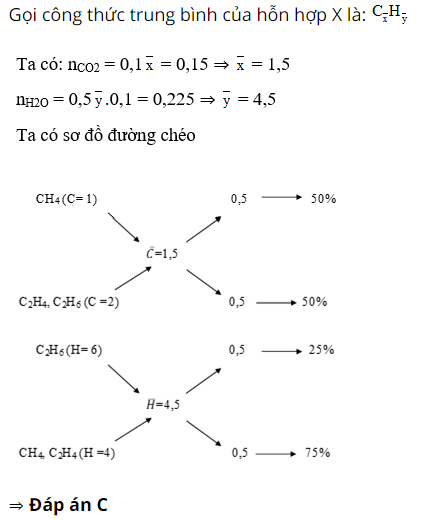
Câu 1 : Đốt cháy 0,1 mol hỗn hợp X gồm CH4, C2H4 và C2H6, sản phẩm thu được dẫn qua bình I đựng dung dịch H2SO4 đặc bình II đựng dung dịch Ca(OH)2 dư. Sau thí nghiệm, thấy bình 2 có 15g kết tủa và khối lượng bình 2 nặng hơn khối lượng bình 1 là 2,55g. Thành phần % về thể tích của mỗi khí trong hỗn hợp là:
A. 50%, 30%, 20%
B. 30%, 40%, 30%
C. 50%, 25%, 25%
D. 50%, 15%, 35%
Giải :
Bình 1 khối lượng tăng là do hấp thụ H2O, bình 2 khối lượng tăng là do hấp thụ CO2
n CO2 = 15 : 100 = 0,15 mol
⇒ m H2O = 0,15.44 – 2,55 = 4,05 ⇒ n H2O = 0,225 mol
Câu 2 :
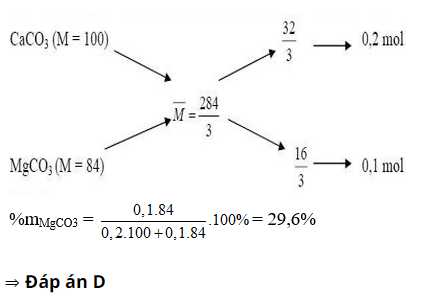
Hoà tan 28,4g 1 hỗn hợp 2 muối cacbonat của 2 kim loại hoá trị II bằng dung dịch HCl dư, thu được 6,72 lít khí ở đktc và dung dịch A. % khối lượng muối có phân tử khối nhỏ hơn trong hỗn hợp ban đầu là:
A. 74,2%
B. 33,3%
C. 70,4%
D. 29,6%
Giải :
Gọi công thức chung 2 muối cacbonat: MCO3
n CO2 = 0,3 mol
⇒ n MCO3 = 0,3 mol
⇒ MCO3 = 94,67
⇒ M = 34,67
⇒ 2 kim loại là Mg và Ca
Ta có sơ đồ đường chéo:
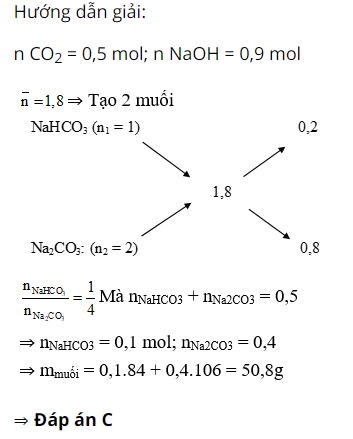
Câu 3 : Nung 56,25g CaCO3 ở 1000°C và cho toàn bộ lượng khí thoát ra hấp thụ hết vào 500ml dung dịch NaOH 1,8M. Khối lượng muối thu được là:
A. 8,4g
B. 42,4g
C. 50,8
D. 59,625g