Trong bài học này chúng ta cùng đi tìm hiểu về sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học.Số lớp electron ngoài cùng quyết định tính chất hóa học của các nguyên tố thuộc nhóm A, sự biến đổi tuần hoàn về cấu hình electron ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần.
SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỐ
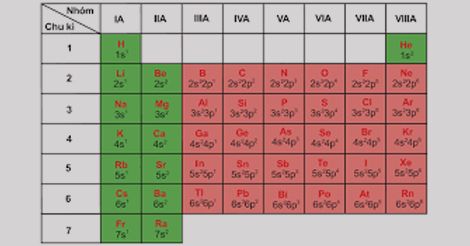
– Từ bảng tuần hoàn các nguyên tố ta thấy, đầu chu kì nguyên tố có cấu hình electron là ns1, cuối mỗi chu kì nguyên tố có cấu hình electron là ns2np6
=> Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một nhóm A được lặp đi lặp lại sau mỗi chu kì
=> Chúng biến đổi một cách tuần hoàn.
=> Chính sự biến đổi tuần hoàn electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần là nguyên nhân của sự biến đổi tuần hoàn tính chất các nguyên tố.
CO2 + O2 xem phản ứng hóa học diễn ra
Oxy là gì? tính chất vật lý và tính chất hóa học của oxy
Liên kết ion là gì? sự hình thành ion và sự tạo thành ion
CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỐ NHÓM A
– Số thứ tự nhóm = số electron hóa trị = số electron lớp ngoài cùng.
– Sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn tính chất của các nguyên tố.
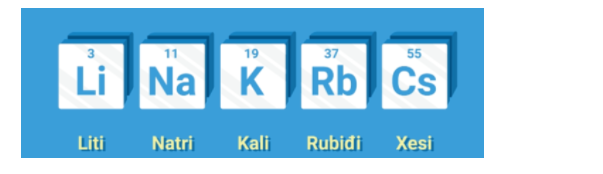
1. Nhóm IA (Nhóm Kim Loại kiềm)
– Gồm các nguyên tố: Li, Na, K, Rb, Cs, Fr
– Cấu hình e lớp ngoài cùng chung: ns1 ⇒ Dễ nhường 1 electron để đạt cấu trúc bền vững của khí hiếm.
– Tính chất hoá học:
+ Tác dụng với oxi tạo oxít bazơ
+ Tác dụng với Phi kim tạo muối
+ Tác dụng với nuớc tạo hiđroxít + H2
2. Nhóm VIIA (Nhóm Halogen)
– Gồm các nguyên tố: F, Cl, Br, I, At
– Cấu hình e lớp ngoài cùng chung: ns2np5 ⇒ Dễ nhận 1 electron để đạt cấu trúc bền vững của khí hiếm.
– Tính chất hoá học:
+ Tác dụng với oxi tạo oxít axít
+ Tác dụng với kim loại tạo muối
+ Tác dụng với H2 tạo hợp chất khí.


3. Nhóm VIIIA (Nhóm khí hiếm)
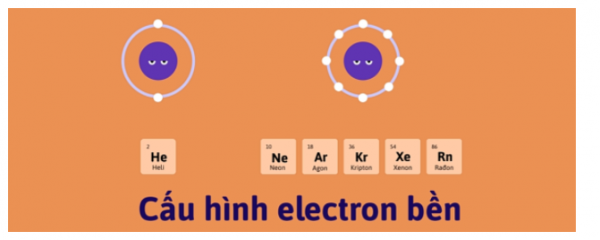
– Gồm các nguyên tố: He, Ne, Ar, Kr, Xe, Rn
– Cấu hình e lớp ngoài cùng chung: ns2np6 (trừ He)
– Hầu hết các khí hiếm không tham gia phản ứng hoá học, tồn tại ở dạng khí, phân tử chỉ 1 nguyên tử.
Cấu hình electron nguyên tử của các nguyên tố nhóm B
Các nguyên tố nhóm B: nguyên tố d và f (còn gọi là các kim loại chuyển tiếp)
– Cấu hình electron nguyên tử có dạng : (n–1)dans2
– Số electron hóa trị = số electron lớp n + số electron phân lớp (n–1)d nhưng chưa bão hòa.
Đặt S = a + 2 , ta có :
+ S ≤ 8 thì S = số thứ tự nhóm.
+ 8 ≤ S ≤ 10 thì nguyên tố ở nhóm VIII B.
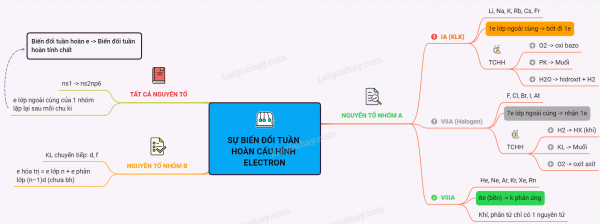
Sơ đồ tư duy: Sự biến đổi tuần hoàn cầu hình electron nguyên tử của các nguyên tố hóa học
Trong bài học này chúng ta đã cùng nhau tìm hiểu biết được thế nào là Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học.Hy vọng sẽ giúp ích được cho các bạn học sinh biết được cấu hình electron nguyên tử của các nguyên tố nhóm A.
Xem thêm :
Axit clohidric là gì? Tính chất và cách điều chế Axit clohidric
H2O CO2 = H2CO3 viết phương trình tác dụng với khí CO2
Hidro clorua là gì? Cấu tạo phân tử và tính chất của HCL