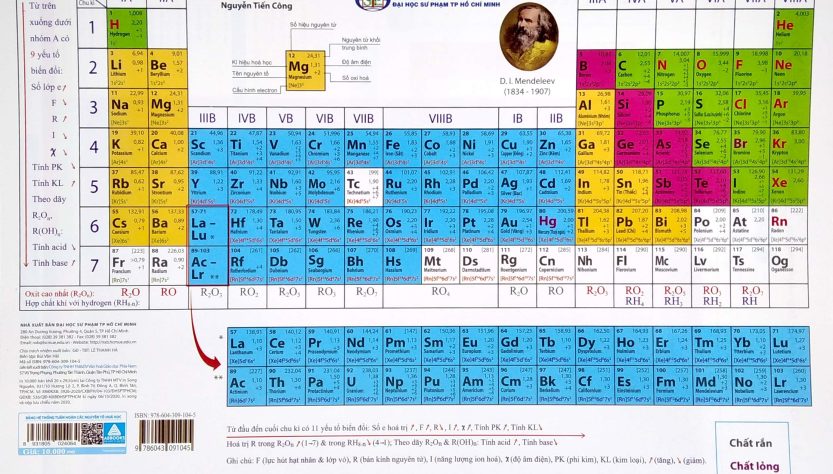
Bảng tuần hoàn các nguyên tố hóa học trong chương trình học lớp 8 mà các em cần lưu ý đặc biệt nếu muốn học tốt môn hóa học. Trong bảng nguyên tố hóa học này bao gồm tên, ký hiệu, số nguyên tử, và khối lượng nguyên tử của các nguyên tố đầy đủ nhất mà bài viết hôm nay https://svnckh.edu.vn/ sẽ gửi đến các bạn nhé!

Bảng tuần hoàn các nguyên tố hóa học là gì?
Bảng tuần hoàn các nguyên tố hóa học (hay còn gọi là bảng tuần hoàn các nguyên tố hoặc bảng tuần hoàn Mendeleev) là một bảng được sắp xếp các nguyên tố hóa học theo thứ tự tăng dần của số proton trong hạt nhân nguyên tử của chúng. Bảng này giúp tổ chức và hiển thị các thông tin quan trọng về các nguyên tố, chẳng hạn như tên, ký hiệu hóa học, khối lượng nguyên tử, cấu trúc điện tử và tính chất hóa học.
Nguyên tố hóa học là các loại nguyên tử có cùng số proton trong hạt nhân, nghĩa là cùng số nguyên tử. Bằng cách sắp xếp các nguyên tố theo thứ tự của số proton, ta có thể tạo ra bảng tuần hoàn, và các dãy ngang trong bảng này gọi là các chu kỳ, trong khi các dãy dọc được gọi là các nhóm hoặc cột.
Bảng tuần hoàn được phát triển bởi các nhà khoa học Dmitri Mendeleev và Julius Lothar Meyer đồng thời và độc lập nhau vào năm 1869. Mendeleev là người đầu tiên công nhận và tổ chức các nguyên tố thành bảng tuần hoàn và dự đoán các nguyên tố chưa được khám phá vào thời điểm đó. Bảng tuần hoàn đã trở thành một công cụ cực kỳ hữu ích trong hóa học và khoa học vật lý, giúp hiểu và dự đoán tính chất của các nguyên tố và hợp chất hóa học.
Bài viết liên quan:
Bảng nguyên tố hóa học
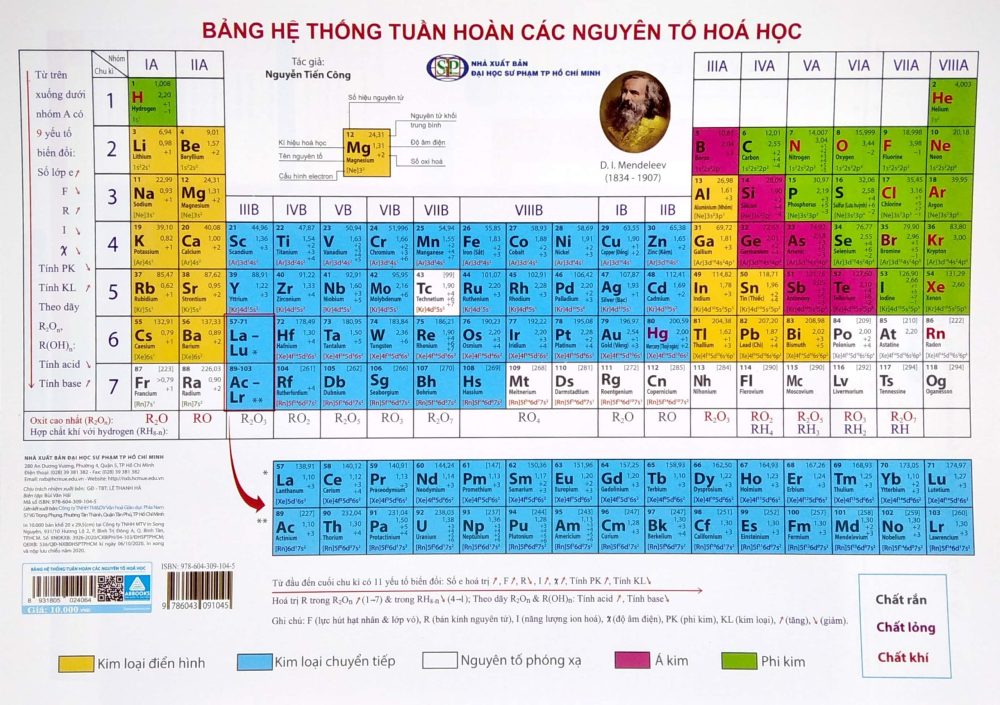
Cấu tạo của bảng tuần hoàn các nguyên tố hóa học lớp 8
Trong bảng nguyên tố hóa học được chia làm 3 phần chính đó là:
1. Ô nguyên tố
Ô nguyên tố cho biết: số hiệu nguyên tử, ký hiệu hóa học, tên nguyên tố, nguyên tử khối của nguyên tố đó.
Số hiệu của nguyên tử có số trị bằng số đơn vị điện tích hạt nhân và bằng số electron trong nguyên tử. Và số hiệu nguyên tử cũng là số thứ tự của nguyên tố trong bảng tuần hoàn.
Ví dụ: Số hiệu nguyên tử của Magie là 12 cho biết: Magie ở ô số 12, điện tích hạt nhân nguyên tử magie là 12+ (hay số đơn vị điện tích hạt nhân là 12), có 12 electron trong nguyên tử Magie.
2. Chu kỳ
Chu kỳ là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron và được xếp theo chiều điện tích hạt nhân tăng dần.
Số thứ tự của chu kỳ bằng số lớp electron.
Bảng tuần hoàn gồm 7 chu kỳ, trong đó có các chu kỳ 1, 2, 3 được gọi là chu kỳ nhỏ, các chu kỳ 4, 5, 6, 7 được gọi là chu kỳ lớn.
– Chu kỳ 1: Gồm 2 nguyên tố là H và He, có 1 lớp electron tong nguyên tử. Điện tích hạt nhân tăng từ H là 1+ đến He là 2+.
– Chu kỳ 2: Gồm 8 nguyên tố từ Li đến Ne, có 2 lớp electron trong nguyên tử. Điện tích hạt nhân tăng từ Li là 3+, … đến Ne là 10+.
– Chu kỳ 3: Gồm 8 nguyên tố từ Na đến Ar, có 3 lớp electron trong nguyên tử. Điện tích hạt nhân tăng dần từ Na là 11+, … đến Ar là 18+.
– Chu kỳ 4 và chu kỳ 5: Mỗi chu kỳ đều có 18 nguyên tố, bắt đầu là một kim loại kiềm K là 19+ và Rb là 37+, kết thúc là một khí hiếm Kr là 36+ và Xe là 54+.
– Chu kỳ 6: Có 32 nguyên tố, bắt đầu từ kim loại kiềm Cs là 55+ và kết thúc là khí hiếm Rn là 86+.
– Chu kỳ 7: Chưa hoàn thành.
3. Nhóm nguyên tố
Nhóm gồm các nguyên tố mà nguyên tử của chúng có số electron lớp ngoài cùng bằng nhau và do đó có tính chất tương tự nhau được xếp thành cột theo chiều tăng của điện tích hạt nhân nguyên tử.
Số thứ tự của nhóm bằng số electron lớp ngoài cùng của nguyên tử.
– Nhóm A: bao gồm các nguyên tố s và p. Số thứ nhóm A = tổng số electron lớp ngoài cùng.
– Nhóm B: bao gồm các nguyên tố d và f có cấu hình electron nguyên tử thì tận cùng ở dạng (n-1)dxnsy:
+ Nếu (x+y) = 3 -> 7 thì nguyên tố thuộc nhóm (x+y)B.
+ Nếu (x+y) = 8 -> 10 thì nguyên tố thuộc nhóm VIIIB.
+ Nếu (x+y) > 10 thì nguyên tố thuộc nhóm (x+y-10)B
Ví dụ:
– Nhóm I: Gồm các nguyên tố kim loại hoạt động mạnh. Nguyên tử của chúng đều có 1 electron ở lớp ngoài cùng. Điện tích hạt nhân tăng từ Li (3+), … đến Fr (87+).
– Nhóm VII: Gồm các nguyên tố phi kim hoạt động mạnh. Nguyên tử của chúng đều có 7 electron ở lớp ngoài cùng. Điện tích hạt nhân tăng từ F (9+), … đến At (85+).
Cách đọc bảng tuần hoàn hóa học
+ Số nguyên tử: Hay còn gọi là số proton của 1 nguyên tố hóa học, là số proton được tìm thấy trong hạt nhân của 1 nguyên tử. Là số điện tích hạt nhân. Số nguyên tử giúp xác định duy nhất một nguyên tố hóa học. Số nguyên tử cũng bằng số electron trong một nguyên tử trung hòa về điện.
+ Nguyên tử khối trung bình: Gần như các nguyên tố hóa học là hỗn hợp của nhiều đồng vị với tỷ lệ phần trăm số nguyên tử xác định. Nên nguyên tử khối của các nguyên tố có nhiều đồng vị là nguyên tử khối trung bình của hỗn hợp các đồng vị có tính đến tỷ lệ phần trăm số nguyên tử tương ứng.
+ Độ âm điện: Độ âm điện của một nguyên tử là khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học. Quy tắc: Độ âm điện của nguyên tử nguyên tố càng lớn thì tính phi kim nguyên tố đó càng mạnh và ngước lại
+ Cấu hình electron: Cấu hình electron nguyên tử cho biết sự phân bố các electron trong lớp vỏ nguyên tử ở các trạng thái năng lượng khác nhau hay ở các vùng hiện diện của chúng.
+ Số oxi hóa: Là số áp cho một nguyên tử hay nhóm nguyên tử. Nhờ số oxi hóa, chúng ta có thể nhận biết được số electron trao đổi khi một chất bị oxi hóa hoặc bị khử trong một phản ứng.
+ Tên nguyên tố: Là một chất hóa học tinh khiết, bao gồm một kiểu nguyên tử, được phân biệt bởi số hiệu nguyên tử, là số lượng proton có trong mỗi hạt nhân.
+ Ký hiệu hóa học: Trong hóa học, ký hiệu là tên viết tắt của một nguyên tố hóa học. Biểu tượng cho các nguyên tố hóa học thường bao gồm 1 hoặc 2 chữ cái trong baeng chữ cái Latin và được viết với chữ cái đầu tiên viết hoa. Các biểu tượng trước đó cho các nguyên tố hóa học bắt nguồn từ từ vựng cổ điển Latin và Hy Lạp.
Trên đây là đầy đủ bảng tuần hoàn các nguyên tố hóa học lớp 8 mà chúng ta cần nhớ và cách đọc hiểu bảng nguyên tố hóa học cho học sinh cần nắm vững kiến thưc.