Để giải thích và trả lời được câu hỏi đầu bài Brom ( Br ) hóa trị mấy? Nguyên tử khối của Brom là bao nhiêu? Các bạn hiểu được rõ Brom là một chất lỏng bốc khói màu nâu đỏ ở nhiệt độ phòng. Nó bốc hơi dễ dàng để hình thành chất khí màu tương tự. Thuộc tính của brom là trung gian giữa clo và iod. Brom nguyên chất có tính phản ứng rất mạnh và do đó không tồn tại brom ở dạng tự do trong tự nhiên. Nó chủ yếu tồn tại trong các dạng muối halogen khoáng tinh thể hòa tan không màu, tương tự như muối ăn. Trong khi brom khá hiếm trong vỏ Trái Đất, độ hòa tan cao của các ion bromide (Br-) đã khiến cho tích lũy của nó trong các đại dương là khá lớn. Có thể dễ dàng tách brom từ các hồ nước muối.

Br hóa trị mấy? Nguyên tử khối của Brom là bao nhiêu?
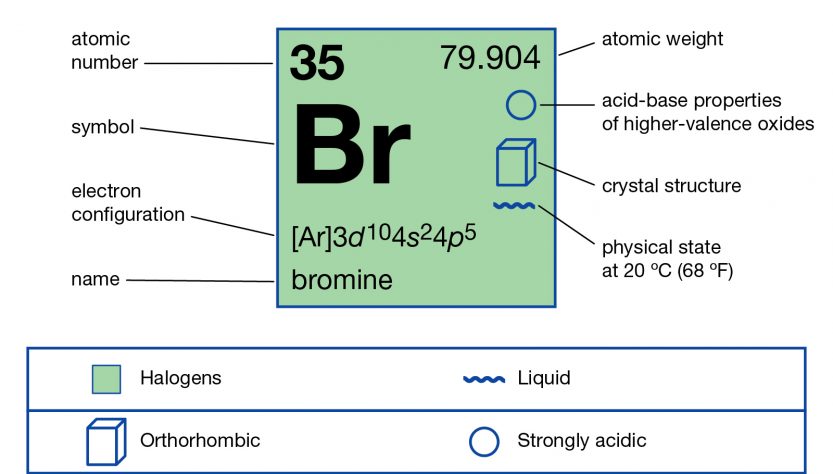
– Nguyên tử khối: 79,91 g/mol (thường lấy là 80 g/mol).
– Brom (Br) có hóa trị bằng I.
Vị trí và cấu tạo của nguyên tử:
– Ký hiệu hóa học: Br.
– Số đơn vị điện tích hạt nhân: Z = 35.
– Độ âm điện: 2,96.
– Số oxi hóa: -1; 0; +1; +3; +5; +7.
– Cấu hình: 1s22s22p63s23p63d104s24p5 hay [Ar] 3d104s24p5.
=> Vị trí: ô số 35; chu kỳ 4; nhóm VIIA.
– Bán kính nguyên tử (nm): 1,14.
– Có 7e lớp ngoài cùng → cấu hình e lớp ngoài cùng là ns2np5 -> .
– Ở trạng thái cơ bản, Brom chỉ thiếu 1 e đạt cấu hình e bền vững của khí hiếm => dễ dàng nhận 1e để tạo thành ion âm Br‑ hoặc tạo 1 liên kết CHT với 1 nguyên tử Br khác tạo Br2.
– Đơn chất của Brom tồn tại ở dạng phân tử do 2 nguyên tử Br kết hợp với nhau bằng liên kết CHT tạo thành (Br2).
– Trong các hợp chất, Brom có các số oxi hóa là -1; 0; +1; +3; +5; +7 (vì Brom còn có phân lớp d trống nên khi được kích thích thì 1e, 2e hoặc 3e sẽ nhảy sang phân lớp d để tạo thành 3; 5 hoặc 7e độc thân nên Brom có các số oxi hóa dương).
Lịch sử tìm ra nguyên tố brom
– Brôm được hai nhà hóa học Antoine Balard và Carl Jacob Löwig phát hiện độc lập với nhau năm 1825 và 1826.
- CO3 hóa trị mấy? Phân tử khối và Cách nhận biết ion CO3
- Kẽm ( Zn ) hóa trị mấy? tính chất hóa học và vai trò của Zn
- SO4 hóa trị mấy? Công thức kim loại M với nhóm SO4
– Balard tìm thấy các muối bromua trong tro của tảo biển từ các đầm lầy nước mặn ở Montpellier năm 1826. Tảo biển được sử dụng để sản xuất iốt, nhưng cũng chứa brôm. Balard chưng cất brôm từ dung dịch của tro tảo biển được bão hòa bằng clo.

Điều chế
– Nguồn chính điều chế brom là nước biển. Sau khi đã lấy muối ăn (NaCl) ra khỏi nước biển, phần còn lại chứa nhiều muối bromua của kali và natri. Sau đó, sục khí clo qua dung dịch, ta có phản ứng hóa học sau:
Cl2 + NaBr → 2NaCl + Br2
* Lưu ý:
– AgBr cũng kém bền khi gặp ánh sáng giống như AgCl .
2AgBr → 2Ag + Br2
Tính chất của Brom :
Tính chất vật lí:
– Trạng thái: chất lỏng, màu đỏ nâu dễ bay hơi; hơi Brom rất độc; có mùi xốc khó chịu (rơi vào da gây bỏng – khó chữa).
– Brom phân hủy ở 600oC.
– Tính tan: tan trong nước → nước brom; tan nhiều trong dung môi hữu cơ: benzene; cacbon đisunfua; cacbon tetraclorua; ete và rượu → Dùng xăng hoặc benzene để chiết Br2 khỏi dung dịch nước.
– Nhiệt độ nóng chảy: -7,3oC; nhiệt độ sôi: 58,2oC.

Tính chất hóa học:
Tính chất hóa học cơ bản: tính oxi hóa mạnh (yếu hơn F2; Cl2).
1. Oxi hóa kim loại (phản ứng tỏa nhiệt)
Br2 + kim loại → muối bromua
VD: 3Br2 + 2Al → 2AlBr3 (nhôm bromua)
2Na + Br2 → 2NaBr (natri bromua)
2. Oxi hóa H2 (đk: to cao, phản ứng 1 chiều)
![]()
Dạng khí: hiđro bromua
Dạng dung dịch: axit bromhiđric (axit mạnh, mạnh hơn axit HCl)
3. Tác dụng chậm với nước → axit bromhiđric HBr + axit hipobromơ HBrO:
Br2 + H2O ⇌ HBr + HBrO
→ Trong phản ứng này Br2 vừa thể hiện tính khử, vừa thể hiện tính OXH.
4. OXH được ion I- → I2
Br2 + 2NaI → 2NaBr + I2
5. Tác dụng với chất OXH mạnh (nước Cl2…):
Br2 + 5Cl2 + 6 H2O → 2HBrO3 + 10HCl
Axit bromic
Ứng dụng
– Brom dùng để chế tạo một số dược phẩm, phẩm nhuộm,…. Nó cũng được dùng chế tạo AgBr (bromua bạc) là chất nhạy với ánh sáng để tráng lên phim ảnh.
Xem thêm tại đây :
Bảng Hóa Trị Lớp 8, Cách Học Thuộc Bằng Bài Ca Hóa Trị Hóa Học.
OH hóa trị mấy? Nguyên tử khối của M trong hidroxit M(OH)3
Hóa trị Bari ( Ba ) là mấy? Nguyên tử khối của Ba
SO3 hóa trị mấy? Công thức cấu tạo và tính chất hóa học của SO3
Clo ( Cl ) hóa trị mấy? Nguyên tử khối của Cl