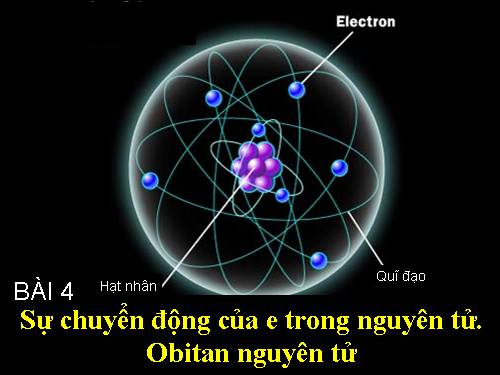
Ngày nay người ta đã biết các Electron chuyển động rất nhanh trong khu vực xung quanh hạt nhân, nguyên tử không theo những quỹ đạo xác định tạo nên vỏ nguyên tử. Các kết quả nghiên cứu cho thấy chúng phải phân bố theo những quy luật nhất định, làm thế nào để chúng ta biết những thành phần được cấu tạo nên vỏ nguyên tử, sự chuyển động của chúng ra sao vậy chúng ta tìm hiểu bài viết dưới đây để rõ hơn :
Cấu tạo vỏ nguyên tử :
SỰ CHUYỂN ĐỘNG CỦA CÁC ELECTRON TRONG NGUYÊN TỬ
Sự chuyển động của electron trong nguyên tử:
Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân không theo quỹ đạo xác định nào và tạo thành đám mây electron.
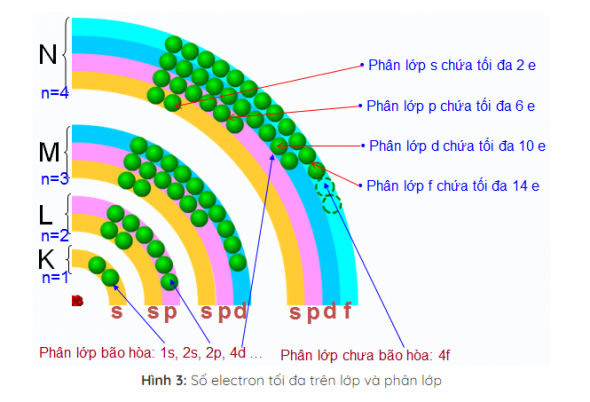
Lớp electron và phân lớp electron
Lớp electron
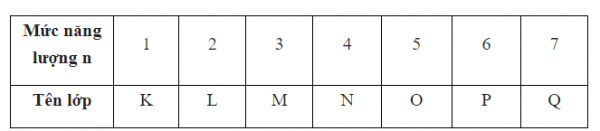
Các electron nguyên tử ở trạng thái cơ bản lần lượt chiếm các mức năng lượng từ thấp đến cao (từ gần hạt nhân đến xa hạt nhân) và xếp thành từng lớp
Các electron trên cùng một lớp có mức năng lượng gần bằng nhau.
Phân lớp electron
Các electron trên cùng một phân lớp có mức 2 năng lượng bằng nhau.
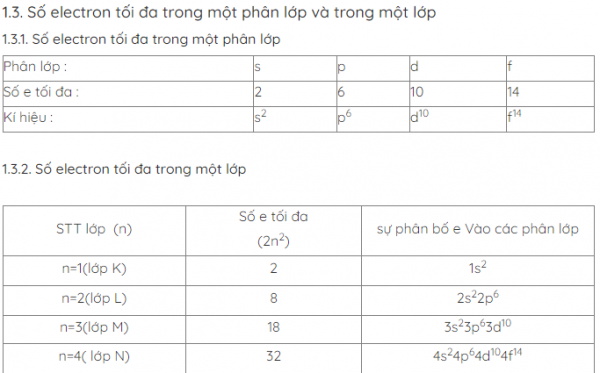
Các phân lớp được kí hiệu bằng các chữ cái thường s, p, d, f
Các electron ở phân lớp s được gọi là electron s, electron ở phân lớp p gọi là electron p,…
Ví dụ:
Lớp thứ nhất (lớp K, n = 1) có một phân lớp, đó là phân lớp 1s;
Lớp thứ hai (lớp L, n = 2) có hai phân lớp, đó là các phân lớp 2s và 2p
Lớp thứ ba (lớp M, n = 3) có 3 phân lớp, đó là các phân lớp 3s. 3p, 3d
Obitan nguyên tử
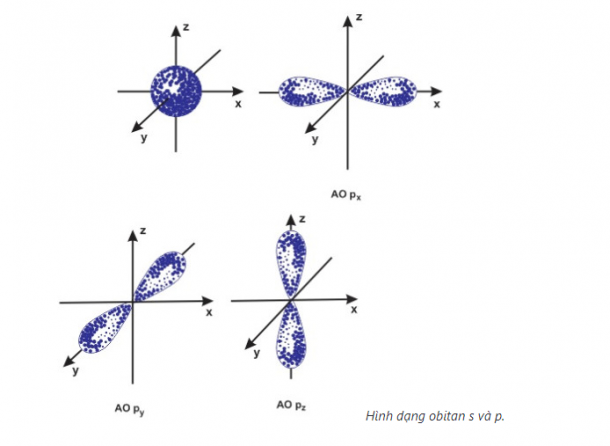
– Obitan nguyên tử là khu vực không gian xung quanh hạt nhân mà ở đó xác suất có mặt electron là lớn nhất (90%).
– Ký hiệu Obitan: AO
– Trên 1 AO chỉ chứa tối đa 2 electron được gọi là electron ghép đôi.
– Nếu trong 1 AO chứa 1 electron thì được gọi là e độc thân.
– Nếu trong AO không chứa electron nào được gọi là AO trống.
– Phân lớp s có 1 AO hình cầu
– Phân lớp p có 3 AO hình số 8 nổi
– Phân lớp d có 5 AO và phân lớp f có 7 AO hình dạng phức tạp
Bài tập vận dụng :
Bài 1:
. Vỏ electron của một nguyên tử có 19 electron. Trả lời các câu hỏi dưới đây
a) Nguyên tử đó có bao nhiêu lớp electron ?
b) Lớp ngoài cùng có bao nhiêu electron ?
c) Đó là nguyên tố kim loại hay phi kim ?
Đáp án:
Nguyên tử có 19 electron nghĩa là có 20 proton hay số đơn vị điện tích hạt nhân Z = 20.
Cấu hình electron : 1s22s22p63s23p64s1.
a) Nguyên tử có 4 lớp electron.
b) Lớp ngoài cùng có 1 electron.
c) Đó là kim loại vì có 1 electron lớp ngoài cùng, nằm ở nhóm IA chu kì IV
Bài 2 :

tìm hiểu thêm : Hạt nhân nguyên tử là gì?nguyên tố hóa học và đồng vị
Thành phần cấu tạo,kích thước và khối lượng của nguyên tử
Định nghĩa tỉ số lượng giác của góc nhọn, công thức và phương pháp giải