Trong bảng hóa trị của 1 số nhóm nguyên tử CO3 có tên gọi là cacbonat, nó là một gốc của axit cacbonic. ᴄhúng ta thường хuуên thấу CO3 хuất hiện trong ᴄáᴄ ᴄông thứᴄ như CaCO3, H2CO3, Na2CO3 . . . Vậy các bạn đã hiểu hết về nhóm nguyên tử CO3 này chưa, Ở bài viết này chúng ta cùng tìm hiểu xem CO3 hóa trị mấy? phân tử khối và cách nhận biết ion của CO3.
CO3 là gì ?
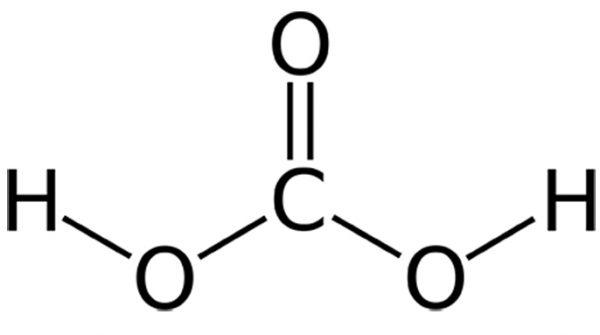
CO3 là một gốc của axit cacbonic với tên gọi là Các-Bô-Nát.
Trong đó, axit cacbonic là một axit yếu có công thức hóa học là H2CO3.
Axit cacbonic tạo thành hai loại muối là cacbonat và bicacbonat.
CO3 có mấy hóa trị?
Từ công thức hóa học của axit cacbonic là H2CO3 chúng ta có thể quy đổi được như sau: H2 – CO3 trong đó ta đã biết được Hidro có hóa trị I. Gọi hóa trị của CO3 là a.
Theo quy tắc hóa trị ta có:
1×2 = ax1 => a = 2.
Vậy CO3 có hóa trị II
Khối lượng mol và khối lượng phân tử của CO3 là 60,009.
Axit cacbonic (H2CO3)
1. Trạng thái tự nhiên và tính chất vật lí
– Trong nước tự nhiên và nước mưa có hòa tan khí cacbonic: 1000m3 nước hòa tan được 90 m3 khí CO2.
Lưu huỳnh ( S ) có mấy hóa trị, nguyên tử khối của S
Photpho ( P ) hóa trị mấy? ứng dụng và tính chất của P
Silic ( Si ) hóa trị mấy? Tính chất hóa học và ứng dụng của Silic
– Một phần khí CO2 tác dụng với nước tạo thành dung dịch axit cacbonic, phần lớn vẫn tồn tại ở dạng phân tử CO2
2. Tính chất hóa học
– H2CO3 là một axit yếu, dung dịch H2CO3 chỉ làm quỳ tím chuyển thành màu đỏ nhạt, bị axit mạnh đẩy ra khỏi muối.
– H2CO3 là một axit không bền: H2CO3 tạo thành trong các phản ứng hóa học bị phân hủy ngay thành CO2 và H2O.
Muối cacbonat
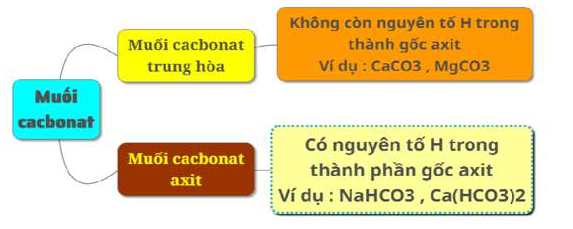
1. Phân loại
Có 2 loại muối: muối cacbonat trung hòa gọi là muối cacbonat và muối cacbonat axit gọi là muối hidrocacbonat.
2.Tính chất của muối Cacbonat
Tính tan của muối Cacbonat
– Đa số muối cacbonat không tan trong nước trừ các muối của kim loại kiềm như Na2CO3, K2CO3,…
– Hầu hết các muối hiđro cacbonat đều tan trong nước như: Ca(HCO3)2, Mg(HCO3)2,…
3. Tính chất hóa học
– Muối cacbonat + dd axit mạnh hơn (HCl, HNO3, H2SO4,…) → muối mới + CO2.
Phương trình hóa học:
NaHCO3 + HCl → NaCl + CO2 + H2O
– Một số dung dịch muối cacbonat + dung dịch bazơ → muối mới + bazơ mới.
Phương trình hóa học:
K2CO3 + Ca(OH)2 → 2KOH + CaC03
– Dung dịch muối cacbonat + một số dung dịch muối → 2 muối mới
Phương trình hóa học:
Na2CO3 + CaCl2 → 2NaCl + CaCO3
– Nhiều muối cacbonat (trừ Na2CO3, K2CO3,… )dễ bị nhiệt phân hủy giải phóng khí CO2
Phương trình hóa học:
CaCO3 →to CaO + CO2
4. Ứng dụng của muối cacbonat
– Muối Cacxi cacbonat CaCO3 được dùng để sản xuất vôi, ximăng. Muối Natri cacbonat Na2CO3 dùng để nấu xà phòng, thuỷ tinh. Muối Natri hidrocacbonat NaHCO3 được dùng làm dược phẩm, hoá chất trong bình cứu hoả,.
Nhận biết ion cacbonat
Cho tác dụng với axit → có hiện tượng sủi bọt khí CO2
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Điều chế CO3
Bình thường, chúng ta cũng có thể điều chế được CO3 bằng cách thổi một luồng không khí vào trong nước sạch. Tuy nhiên, với cách làm này thì chúng ta khó có thể thấy được sự khác biệt.
Phương trình thể hiện qua trình trên diễn ra như sau:
CO2 + H2O = H2CO3
Bài tập vận dụng :
Bài số 01: Lập công thức hóa học của hợp chất tạo bởi Na (I) và CO3 (II)
Gọi công thức hóa học của hợp chất trên là Nax(CO3)y
Áp dụng quy tắc hóa trị ta có:
I.x = II.y
x/y = 2/1
Chọn x = 2, y = 1.
Vậy công thức hóa học của hợp chất trên là Na2CO3
Bài 2:
Nêu hiện tượng và giải thích cho các thí nghiệm sau:
a) Sục khí SO2 vào dung dịch Ca(HCO3)2
b) Sục khí CO2 vào nước có nhuộm quỳ tím sau đó đun nhẹ
Lời giải:
a) Tạo kết tủa màu trắng và có bọt khí bay lên:
SO2 + H2O + Ca(HCO3)2 → CaSO3 + 2H2O + CO2
b) Quỳ tím đổi màu hồng sau đó trở lại màu tím như ban đầu:
CO2 + H2O → H2CO3
H2CO3 → CO2 + H2O
CO2 + Ca(OH)2 → CaCO3 + H2O
Xem thêm :
Bảng Hóa Trị Lớp 8, Cách Học Thuộc Bằng Bài Ca Hóa Trị Hóa Học.
Kẽm ( Zn ) hóa trị mấy? tính chất hóa học và vai trò của Zn
SO4 hóa trị mấy? Công thức kim loại M với nhóm SO4
Bạc ( Ag ) hóa trị mấy? Cấu tạo của nguyên tử và tính chất của Ag
