Để hiểu rõ được các dạng bài tập trong bộ môn hóa học mình cần phải làm những gì? khi đọc tiêu đề ở bài tập. Vì không chỉ trong những bài kiểm tra trên lớp mà trong các kỳ thi học kỳ, THPT quốc gia cũng có rất nhiều câu hỏi mà bài tập mình cần phải nắm vững. Viết phương trình phản ứng hóa học của một chất cũng vậy, chất nào tác dụng được với chất nào để điều chế ra được chất mình cần quan tâm, sau đây chúng tôi sẽ hướng dẫn các bạn cách viết phương trình hóa học khi chất NO2 ra HNO3. Mời các bạn cùng theo dõi.
Xem thêm :
Phương trình phản ứng hóa học đã cân bằng :
H2O + 3NO2 ⟶ 2HNO3 + NO
Điều kiện để phương trình diễn ra : Nhiệt độ
Cách thực hiện thí nghiệm : dẫn khí NO2 qua nước, sau đó có khí thoát ra không màu ta thấy hiện tượng Khí Nitơ đioxit (NO2) màu nâu đỏ mất dần và xuất hiện khí Nitơ oxit (NO) bị hóa nâu đỏ ngoài không khí.
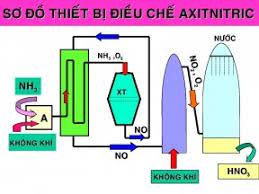
Các phương trình điều chế HNO3 :
– H2O2 + HNO2 ⟶ H2O + HNO3
– H2SO4 + KNO3 ⟶ HNO3 + KHSO4
– H2O2 + N2O5 ⟶ HNO3 + HNO4
– Mg(NO3)2.6H2O ⟶ 5H2O + HNO3 + Mg(OHNO3
Tính chất hóa học của HNO3 axit nitric :
Một dung dịch nitrat hydro axit nitric công thức hóa học là HNO3 . Đây là một loại axit khan, là một axit mạnh, có tính oxi hóa mạnh có thể nitrat nhiều hợp chất vô cơ, có hằng số cân bằng axit (pKa) = −2.
Axit nitric là một loại mono proton chỉ có một sự phân ly nên trong dung dịch, nó bị điện li hoàn toàn thành những ion nitrat NO3− và một proton hydrat, hay còn gọi là ion hidroxoni.
H3O+ HNO3 + H2O → H3O+ + NO3-
Axit nitric có tính chất là một axit bình thường nên nó sẽ làm quỳ tím chuyển sang màu đỏ.
Tác dụng với hóa chất bazo, oxit bazo, muối cacbonat tạo thành các muối nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
– Axit nitric khi tác dụng với kim loại: Tác dụng với hầu hết các kim loại trừ Au và Pt tạo thành muối nitrat và nước .
Kim loại + HNO3 đặc → muối nitrat + NO + H2O (to)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
Nhôm, sắt, crom thụ động với axit nitric đặc nguội do lớp oxit kim loại tạo ra bảo vệ chúng không bị oxy hóa tiếp.
– Tác dụng với phi kim (các nguyên tố á kim, ngoại trừ silic và halogen) tạo thành nitơ dioxit nếu axit nitric đặc và oxit nitơ với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
– Tác dụng với dung dịch oxit bazo, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
– Tác dụng với hợp chất:
3H2S + 2HNO3 (>5%) → 3S (kết tủa) + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan trong HNO3, HgS không tác dụng với HNO3
– Tác dụng với nhiều loại hợp chất hữu cơ: Axit nitric có khả năng phá hủy nhiều hợp chất hữu cơ, nên sẽ rất nguy hiểm nếu để axit này tiếp xúc với cơ thể con người.
Lưu ý khi sử dụng dung dịch axit nitric HNO3
Axit nitric là một chất oxy hóa mạnh, khi tác dụng với cyanit, bột kim loại có thể phát nổ và tự động bốc cháy khi phản ứng với turpentine.
Ở nồng độ đậm đặc, HNO3 gây bỏng da do phản ứng với protein keratin, khiến da chuyển sang màu vàng. Khi được trung hòa sẽ chuyển hóa thành màu cam.
Có thể phản ứng mạnh với những kim loại tạo thành khí hydro dễ cháy trong không khí.
Khi pha loãng, tuyệt đối không đổ nước vào axit mà phải cho axit vào nước.
Sử dụng những thùng chứa bằng nhựa thay cho kim loại vì axit nitric sẽ không tác dụng với chất liệu này.
Những thùng chứa phải đậy nắp kín, tránh ánh sáng mặt trời.
Khu vực cất giữ phải thoáng mát, tránh xa các nguồn nhiệt.
Nền nhà phải chống được axit.