Kẽm ( Zn ) có nguyên tử khối là bao nhiêu? Viết cấu hình Electron của Zn câu hỏi này sẽ được giải thích như thế nào cho chuẩn xác nhất? Sau đây dưới bài viết này chúng tôi sẽ giải thích cho các em cũng như các bạn yêu thích môn hóa học 1 cách đầy đủ nhất.
Kẽm là một nguyên tố kim loại chuyển tiếp, Nó là nguyên tố đầu tiên trong nhóm 12 của bảng tuần hoàn các nguyên tố. Kẽm, trên một số phương diện, có tính chất hóa học giống với magiê, vì ion của chúng có bán kính giống nhau và có số oxy hóa duy nhất ở điều kiện bình thường là +2. Kẽm là nguyên tố phổ biến thứ 24 trong lớp vỏ Trái Đất và có 5 đồng vị bền. Quặng kẽm phổ biến nhất là quặng sphalerit, một loại kẽm sulfide.
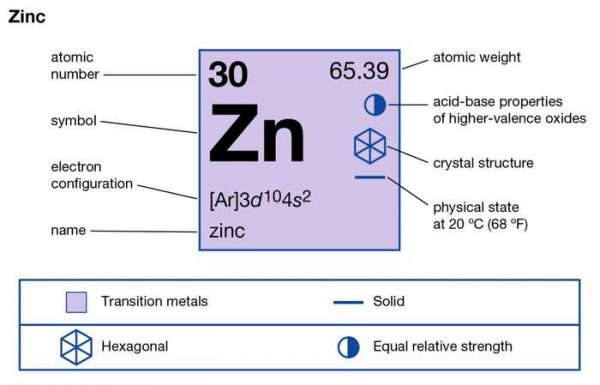
Kẽm ( Zn ) có nguyên tử khối là bao nhiêu? Viết cấu hình Electron của Zn
– Nguyên tử khối của Zn là: 65
– Zn hóa trị II
– Kẽm có số hiệu nguyên tử là 30 ⇒ nguyên tử Zn có 30 electron.
– Cấu hình electron nguyên tử kẽm là 1s2 2s2 2p6 3s2 3p6 3d10 4s2.
Viết gọn: [Ar] 3d10 4s2.
- Sắt ( Fe ) hóa trị mấy? Sắt là gì? Nguyên tử khối của Fe
- Kim loại kiềm hóa trị mấy? Kim loại kiềm gồm những nguyên tố nào?
- SO2 hóa trị mấy? Cấu tạo phân tử của khí SO2
Chú ý:
– Do có sự chèn mức năng lượng, các electron được phân bố như sau:
1s2 2s2 2p6 3s2 3p6 4s2 3d10.
– Sau đó, sắp xếp các phân lớp theo từng lớp để thu được cấu hình electron như trên.
Mối quan hệ giữa cấu hình electron với vị trí trong bảng tuần hoàn và tính chất nguyên tố
– Vị trí Zn trong bảng tuần hoàn:
+ Từ cấu hình electron của Zn là 1s2 2s2 2p6 3s2 3p6 3d10 4s2 ta xác định được nguyên tử Zn có 30 electron, phân bố trên 4 lớp electron và số electron hóa trị bằng 2.
⇒ Vậy kẽm ở ô thứ 30 (do Z = 30); chu kì 4 (do có 4 lớp electron), nhóm IIB (do có 2 electron hóa trị, nguyên tố d).
– Tính chất nguyên tố:
+ Kẽm thuộc chu kì 4, nhóm IIB nên kẽm là kim loại chuyển tiếp dãy thứ nhất.
+ Trong các phản ứng hóa học, kẽm có xu hướng nhường 2 electron.
Zn ⟶ Zn2+ + 2e
+ Số oxi hóa phổ biến của kẽm trong hợp chất: +2.

Phân bố kẽm ( Zn )
Kẽm chiếm khoảng 75 ppm (0,0075%) trong vỏ Trái Đất, là nguyên tố phổ biến thứ 24. Đất chứa 5-770 ppm kẽm với giá trị trung bình 64 ppm. Nước biển chỉ chứa 30 ppb kẽm và trong khí quyển chứa 0,1-4 µg/m3.
Nguyên tố này thường đi cùng với các nguyên tố kim loại thông thường khác như đồng và chì ở dạng quặng. Kẽm là một nguyên tố ưa tạo quặng (chalcophile), nghĩa là nguyên tố có ái lực thấp với oxy và thường liên kết với lưu huỳnh để tạo ra các sulfide. Các nguyên tố ưa tạo quặng hình thành ở dạng lớp vỏ hóa cứng trong các điều kiện khử của khí quyển Trái Đất. Sphalerit là một dạng kẽm sulfide, và là loại quặng chứa nhiều kẽm nhất với hàm lượng kẽm lên đến 60-62%.
Các loại quặng khác có thể thu hồi được kẽm như smithsonit (kẽm cacbonat), hemimorphit (kẽm silicat), wurtzit (loại kẽm sulfide khác), và đôi khi là hydrozincit (kẽm cacbonat).Ngoại trừ wurtzit, tất cả các khoáng trên được hình thành từ các quá trình phong hóa kẽm sulfide nguyên sinh.
Đồng vị của kẽm:
Kẽm có trong tự nhiên ( 30 Zn) bao gồm 5 đồng vị bền 64 Zn, 66 Zn, 67 Zn, 68 Zn và 70 Zn trong đó 64 Zn là đồng vị dồi dào nhất (48,6% lượng tự nhiên ). 25 đồng vị phóng xạ đã được đặc trưng với số lượng nhiều nhất và ổn định nhất là 65 Zn với chu kỳ bán rã 244,26 ngày và 72 Zn với chu kỳ bán rã 46,5 giờ. Tất cả các chất phóng xạ còn lạiCác đồng vị có chu kỳ bán rã nhỏ hơn 14 giờ và phần lớn trong số này có chu kỳ bán rã nhỏ hơn 1 giây. Yếu tố này cũng có 10 trạng thái meta .

Kẽm đã được đề xuất làm nguyên liệu ” ướp muối ” cho vũ khí hạt nhân . Một chiếc áo khoác của đồng vị giàu 64 Zn, chiếu xạ bởi các năng lượng cao thông lượng neutron dữ dội từ một vụ nổ nhiệt hạch vũ khí , sẽ chuyển hóa thành các đồng vị phóng xạ 65 Zn với chu kỳ bán rã của 244 ngày và sản xuất khoảng 1,115 MeV của bức xạ gamma , làm tăng đáng kể hoạt độ phóng xạ của bụi phóng xạ của vũ khí trong vài năm. Một loại vũ khí như vậy không được biết là đã từng được chế tạo, thử nghiệm hoặc sử dụng hay chưa.
Hợp chất của Kẽm :
Hợp chất hai nguyên tố của kẽm được tạo ra với hầu hết á kim và tất cả các phi kim trừ khí hiếm. ZnO là chất bột màu trắng và hầu như không tan trong các dung dịch trung tính, vì là một chất trung tính nó tan trong cả dung dịch acid và base.Các chalcogenua khác (ZnS, ZnSe, và ZnTe) có nhiều ứng dụng khác nhau trong điện tử và quang học.
Xem thêm tại đây:
Nguyên tử khối là gì ? Bảng nguyên tử khối hóa học và mẹo học nhanh
Bảng Nguyên Tử Khối Các Nguyên Tố Hóa Học Lớp 8.
Bạc ( Ag ) có nguyên tử khối là bao nhiêu? Bạc có mấy đồng vị
Thủy ngân ( Hg ) hóa trị mấy? Hg là gì? Nguyên tử khối của Thủy ngân ( Hg )
Mangan ( Mn ) hóa trị mấy? Mn có mấy điện tử hóa trị? Kim loại hay phi kim
