SO2 hóa trị mấy? Cấu tạo phân tử của khí SO2? để hiểu rõ được nội dung của nhóm nguyên tử SO2 như thế nào thì dưới bài này chúng tôi đã tóm tắt được nội dung chính chủ yếu giúp các bạn học tốt môn hóa học để vận dụng làm bài tập cũng như ứng dụng trong cuộc sống hàng ngày.
SO2 hóa trị mấy? Cấu tạo phân tử của khí SO2
Câu hỏi: Tính hóa trị của S trong hợp chất SO2
Lời giải:
Theo quy tắc hóa trị: a.1=2.II => a=IV
Vậy S hóa trị IV trong hợp chất SO2
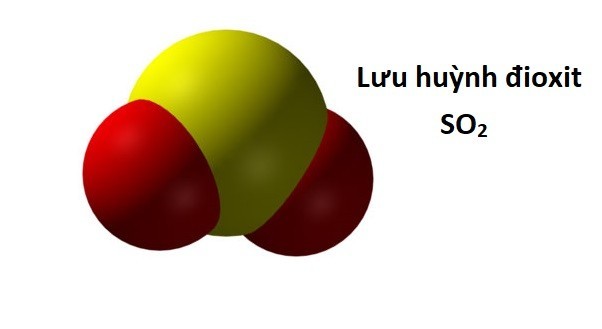
– Công thức phân tử: SO2
– Công thức cấu tạo: O = S = O

Lưu huỳnh đioxit là gì? Nguồn gốc hình thành lưu huỳnh đioxit
Lưu huỳnh đioxit hay anhiđrit sunfurơ là một hợp chất hóa học có công thức SO2. Đây là một khí vô cơ không màu, nặng hơn không khí và là sản phẩm chính của sự đốt cháy hợp chất lưu huỳnh.
- Nguyên tử khối của Kali là bao nhiêu? Kali ( K ) hóa trị mấy ?
- Brom ( Br ) hóa trị mấy? Nguyên tử khối của Brom là bao nhiêu?
- OH hóa trị mấy? Nguyên tử khối của M trong hidroxit M(OH)3
Các tên gọi khác: sulfur dioxit, lưu huỳnh oxit, khí SO2.
1. Trong tự nhiên
– Khí thoát ra từ vụ núi lửa phun trào
– Các hợp chất sinh học có chứa lưu huỳnh phân hủy tạo ra SO2 và oxit lưu huỳnh
2. Nhân tạo
– Khói thải từ các nhà máy lọc dầu, đốt than, luyện kim, sản xuất xi măng, bột giấy, công nghiệp chế biến.
– Khí thải sinh ra từ các phương tiện giao thông: ô tô, xe máy,…
– Sinh hoạt hàng ngày: khói thuốc lá, thiết bị dùng gas làm nhiên liệu không đúng cách hay thiếu khí, khí thải sinh ra từ quá trình đốt rơm, gỗ, than đá,…
Tính chất của nguyên tử SO2:
Tính chất vật lý
Do SO2 là sản phẩm chính dưới sự đốt cháy hợp chất lưu huỳnh nên khí SO2 được mô tả là có mùi rất hôi khi bị đốt cháy.
– Là chất khí không màu và nặng hơn không khí
– Tan trong nước
– Khối lượng riêng: 2,551 g/l, gas
– Điểm nóng chảy: -72,4 oC (200.75 K)
– Điểm sôi: -10 oC (263 K)
– Độ hòa tan trong nước: 9,4 g/100ml (ở 25 oC)
Tính chất hóa học
– Là chất khí không màu, nặng hơn không khí, mùi hắc, độc, tan và tác dụng được với nước.
* SO2 là oxit axit
a) Lưu huỳnh đioxit Tác dụng với nước:
SO2 + H2O ⇋ H2SO3
b) Lưu huỳnh đioxit Tác dụng với dung dịch bazơ (có thể tạo thành 2 loại muối sunfit và hiđrosunfit)
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
c) Lưu huỳnh đioxit Tác dụng với oxit bazơ → muối:
SO2 + CaO → CaSO3
* SO2 vừa là chất khử, vừa là chất oxi hóa (do S trong SO2 có mức oxi hóa trung gian +4)
d) Lưu huỳnh đioxit là chất oxi hóa:
SO2 + 2H2S → 3S + 2H2O
e) Lưu huỳnh đioxit là chất khử:
2SO2 + O2 ⇋ 2SO3 (V2O5, 4500C)
Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Điều chế, nhận biết và ứng dụng của Lưu huỳnh đioxit SO2
1. Điều chế lưu huỳnh đioxit SO2
* Điều chế SO2 trong phòng thí nghiệm
Sản xuất SO2 trong phòng thí nghiệm theo phương trình:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2
* Điều chế SO2 trong công nghiệp
Đốt lưu huỳnh:
S + O2 (to) → SO2
Đốt cháy H2S trong oxi dư
2H2S + 3O2 → 2H2O + 2SO2
Cho kim loại phản ứng với H2SO4 đặc nóng
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Đốt pyrit sắt
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2. Nhận biết Lưu huỳnh đioxit:
– Làm quỳ tím ẩm chuyển thành màu đỏ.
– Làm mất màu dung dịch nước brom, dung dịch thuốc tím,…
SO2 + 2H2O + Br2 → 2HBr + H2SO4
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
3. Ứng dụng Lưu huỳnh đioxit
– Sản xuất axit sunfuric, tẩy trắng giấy, bột giấy; Chống nấm mốc cho lương thực, thực phẩm.

– Ngoài các ứng dụng trên, SO2 còn là chất gây ô nhiễm môi trường. Nó là nguyên nhân gây ra hiện tượng mưa axit.
Xem thêm tại đây:
Bảng Hóa Trị Lớp 8, Cách Học Thuộc Bằng Bài Ca Hóa Trị Hóa Học.
Chì ( Pb ) hóa trị mấy? Khối lượng mol của pb
Crom ( Cr ) hóa trị mấy? Nguyên tử khối của Cr? M của Cr là bao nhiêu?
Muối photphat ( PO4 ) hóa trị mấy? PO4 là gì? Tính chất của PO4
Đặc điểm, Tính chất hóa học của Đồng ( Cu )? Đồng ( Cu ) hóa trị mấy?
